Coefficient de diffusion
Le coefficient de diffusion est défini pour un composé dans un milieu :
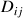 est le coefficient de diffusion du composé
est le coefficient de diffusion du composé
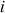 dans le milieu
dans le milieu
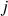 .
.
Il dépend de la pression et de la température.
Les coefficients de diffusion peuvent être trouvés dans la littérature ou calculés à l'aide de corrélations.
En phase gazeuse
Corrélation de Fuller et al (1969)
Exemple :
D = 2,42.10-5 m2.s-1 pour vapeur d'eau / air à 20°C
D = 1,47.10-5 m2.s-1 pour CO2 / air à 20°C
D = 2,02.10-5 m2.s-1 pour O2 / air à 20°C
En phase liquide
Corrélations :
Wilke et Chang (1955)
Hayduk et Laudi (1974) (eau comme solvant)
Perkins et Geankoplis (1969) (pour mélange de liquides)
Exemple :
D = 9,3.10-9 m2.s-1 pour H+/ H2O à 25°C
D = 4,6.10-10 m2.s-1 pour sucre / H2O à 20°C
Définition :
2ème loi de Fick (diffusion + convection)
La 2ème loi de Fick prend en compte le transport par le mouvement moyen du fluide.
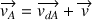
où :
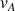 : vitesse de déplacement de A (m.s-1)
: vitesse de déplacement de A (m.s-1)
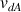 : vitesse de diffusion de A (m.s-1)
: vitesse de diffusion de A (m.s-1)
 : vitesse moyenne de l'écoulement (m.s-1)
: vitesse moyenne de l'écoulement (m.s-1)
Le flux global de composé A (
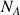 ) résulte de la somme du flux diffusif (
) résulte de la somme du flux diffusif (
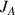 ) et du flux par transport convectif (
) et du flux par transport convectif (
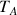 ) :
) :
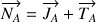
avec :
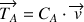
où :
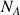 : flux global du composé A (kg.m-2.s-1 ou mol.m-2.s-1)
: flux global du composé A (kg.m-2.s-1 ou mol.m-2.s-1)
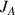 : flux de diffusion du composé A (kg.m-2.s-1 ou mol.m-2.s-1)
: flux de diffusion du composé A (kg.m-2.s-1 ou mol.m-2.s-1)
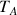 : flux par transport convectif du composé A (kg.m-2.s-1 ou mol.m-2.s-1)
: flux par transport convectif du composé A (kg.m-2.s-1 ou mol.m-2.s-1)
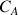 : concentration molaire ou massique de A dans le mélange (kg.m-3 ou mol.m-3)
: concentration molaire ou massique de A dans le mélange (kg.m-3 ou mol.m-3)





