Aspects théoriques
Aspect thermodynamique de l'évaporation
L'évaporation est le passage de l'état liquide à l'état gazeux.
C'est donc un phénomène de changement d'état
L'évaporation est endothermique, c'est-à-dire qu'elle demande de la chaleur à l'environnement.
Cette quantité d'énergie est non négligeable et correspond à la chaleur latente de vaporisation
La chaleur latente de vaporisation est aussi appelée enthalpie de vaporisation, molaire ou massique, et est égale à la quantité de chaleur nécessaire à l'unité de quantité de matière (mole) ou de masse (kg) d'un corps pour qu'il passe de l'état liquide à l'état gazeux.
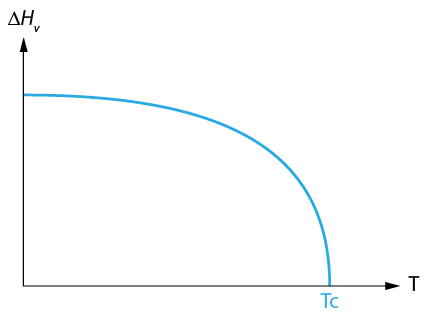
La chaleur latente varie avec la température
Formule de Regnault :
(
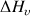 en kcal/kg et
en kcal/kg et
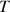 en °C)
en °C)sur un domaine étendu de température
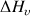 varie considérablement
varie considérablement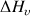 diminue quand la Température augmente
diminue quand la Température augmente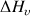 tend vers 0 quant la température tend vers
tend vers 0 quant la température tend vers
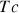
Implications liés à la température et la pression
Le solvant subit une ébullition puis une vaporisation à une température donnée sous une pression donnée
L'ébullition a lieu quand la pression de vapeur de la solution est supérieure ou égale à la pression totale de la phase vapeur
La pression qui impose la température d'ébullition est affectée par les conditions de circulation du liquide
Équation de Clapeyron (sous sa forme intégrée) :
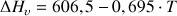
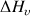 est supposée constante
est supposée constantepermet de calculer la pression de vapeur d'équilibre
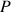 à la température
à la température
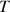 à partir de
à partir de
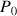 ,
,
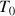 et de
et de
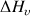
Dans un souci de simplification tout en conservant une approximation satisfaisante, il est courant de négliger la variation de la chaleur latente de fusion avec la température. Elle est donc très souvent considérée comme constante.
Élévation ébullioscopique
- C'est l'élévation du point d'ébullition de la solution par rapport à celui du solvant pur
- La présence des substances dissoutes dans des solutions entraine :
Une réduction de la pression de vapeur
Une élévation de la température d'ébullition
Dans le calcul des évaporateurs c'est l'élévation ébullioscopique qui est utilisée
L'équation d'Antoine , est issue d'une loi empirique qui permet de mettre en relation la tension de vapeur et la température d'ébullition. Elle donne la pression de vapeur saturante d'une substance pour un intervalle de température donné:
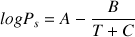
avec
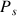 : pression de vapeur en Pascals (Pa)
: pression de vapeur en Pascals (Pa)
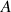 ,
,
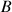 ,
,
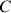 : coefficients d'Antoine
: coefficients d'Antoine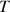 : température en Kelvins (K)
: température en Kelvins (K)
En isolant la température on obtient :
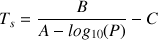
Qui donne la température d'une solution à une certaine pression
substance | Coefficient A | Coefficient B [K] | Coefficient C [K] | Température [K] |
Eau | 3.55959 | 643.748 | 198.043 | 379 - 573 |
5.40221 | 1838.675 | -31.737 | 273- 303 | |
5.20389 | 1733.926 | -39.485 | 304- 333 | |
5.07680 | 1659.793 | -45.854 | 334 - 363 | |
5.08354 | 1663.125 | -45.662 | 344 - 373 | |
6.20963 | 2354.731 | 7.559 | 293 - 343 | |
4.65430 | 1435.264 | -64.848 | 255.8 - 373 |
Aspects physiques
Implications liés au transfert de chaleur
Dans un évaporateur industriel, le fluide caloporteur est généralement de la vapeur d'eau
La vapeur se condense au niveau de la section de l'évaporateur conçue pour assurer le transfert de chaleur; cette section joue le rôle de l'échangeur thermique
Plus on échange de chaleur, plus on évapore.
Recherche de matériaux offrant :
Conductivité la plus élevée possible
Une bonne résistance avec un minimum d'épaisseur
Une surface lisse facile à nettoyer
Choix entre alliages et métaux purs
Résistance thermique des couches déposées
La résistance thermique due à ces couches peut ne pas être négligeable : le rapport
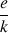 va en augmentant du fait que «
va en augmentant du fait que «
 » augmente avec le temps et
» augmente avec le temps et
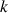 de nature est faible
de nature est faible
Choix judicieux des conditions opératoires pour minimiser les dépôts (ex vitesse de circulation)
Utilisation des techniques de nettoyage appropriées (chimique, mécanique et autres)
Les facteurs favorisant l'évaporation sont:
la surface (étendre le linge favorise l'évaporation)
la convection du gaz (le vent favorise le séchage par évaporation)
un apport de chaleur (le soleil aussi favorise le séchage par évaporation), et non pas une haute température, car l'évaporation est endothermique, c'est-à-dire qu'elle demande de la chaleur à l'environnement.
Par contre plus le taux d'humidité dans l'air est élevé moins l'évaporation est importante.
Aspects énergétiques
L'évaporation nécessite un apport thermique important
La majorité des installations utilise de la vapeur comme fluide caloporteur
Les consommations spécifiques théoriques sont de l'ordre de 800 à 1000kkWh par tonne d'eau évaporée
Les besoins énergétiques nécessaires à la condensation et au fonctionnement des équipements auxiliaires ne sont pas inclus dans ce bilan
C'est donc une opération unitaire à fort cout énergétique
L'optimisation énergétique passe principalement par une diminution :
Des consommations en source chaude (vapeur primaire) et en source froide (eau de refroidissement pour la condensation)
Consommation des postes énergétiques annexes
Implications liés au produit
Changement de texture, à quelle T?
Changement de composition, à quelle T?
En fonction de la nature et de la quantité de salinité de la solution à concentrer, l'enrichissement du concentrât peut conduire à dépasser la limite de saturation et provoquer l'apparition d'une phase solide cristallisée.





